показать полностью
Авторы: Шинкарев С.А. – д.м.н., профессор, главный врач Липецкого областного онкологического диспансера ГБУЗ ЛООД (научный руководитель проекта ОНКОНЕТ) Каргальская И.Г. – руководитель Комитета "Пациентоориентированная телемедицина" при Всероссийском Союзе пациентов (технический директор ОНКОНЕТ) Зингерман Б.В. – научный руководитель ООО "Телепат", программный директор Онконет Нозик А.В. – ведущий разработчик ОНКОНЕТ
Онкологические пациенты страдают от множества симптомов, вызванных как самим заболеванием, так и побочными эффектами противоопухолевого лечения. Многие симптомы остаются незамеченными по причине удаленного местожительства пациента, значительных перерывов между визитами к врачу, различий в индивидуальном анамнезе заболевания и недостаточной коммуникации между врачом и пациентом [1-7]. В целом ухудшение симптомов указывает на прогрессирование рака или серьезные нежелательные явления и служит причиной снижения выживаемости [8].
Повсеместное рутинное использование разными категориями пациентов смартфонов и планшетов делает крайне актуальной идею оперативного сбора индивидуальных данных о состоянии здоровья пациента с использованием каналов мобильной связи [9].
С 2016 года в США и Европе начинают активно использовать цифровые инструменты, вовлекающие пациентов в сбор дополнительной информации о своем состоянии и передачу ее в электронном виде лечащему врачу, что позволяет своевременно и непрерывно собирать и анализировать в автоматическом режиме данные о самочувствии пациента, находящегося за пределами лечебного учреждения [10-16]. В случае если такой сбор актуальных симптомов еще и сопровождается возможностью автоматических экстренных уведомлений («алармов»), посылаемых в опасных ситуациях пациенту и его лечащему врачу, это дает пациенту шанс своевременно среагировать на проблему, связаться с врачом и снизить возможность развития ургентных состояний или вовремя вызвать Скорую помощь.
В настоящее время существуют убедительные доказательства эффективности такого мониторинга [17-20].
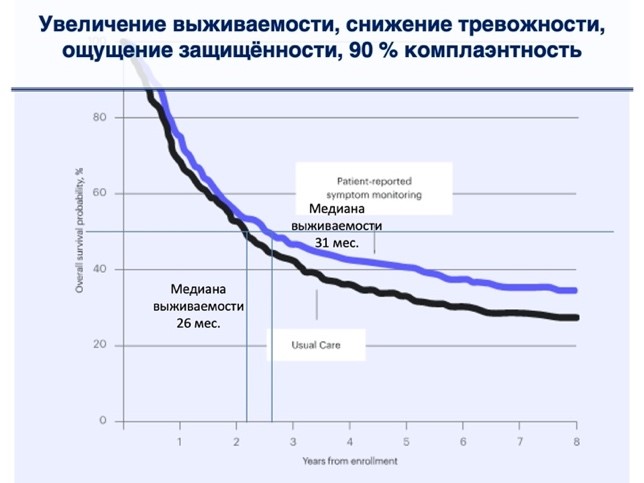
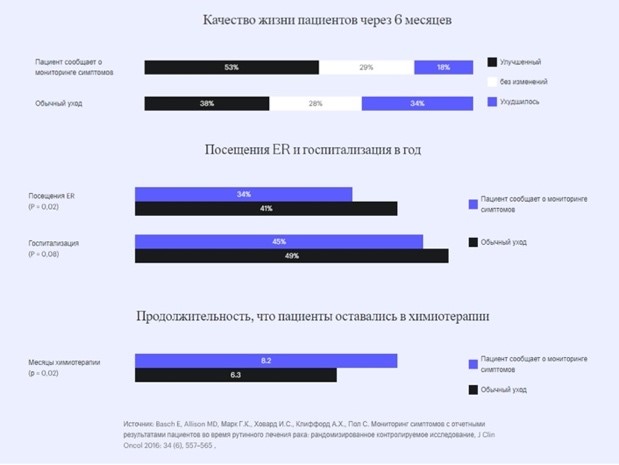
Так по данным рандомизированного клинического исследования [20], в котором принимали участие 766 пациентов с различными формами рака (в т.ч. пациенты старше 55 лет с минимальным уровнем компьютерной грамотности), информировавших врача онлайн о своих симптомах в процессе лекарственной терапии, зафиксировано более высокое качестве жизни пациентов, снижение посещений отделений неотложной помощи и увеличение медианы выживаемости на 5 месяцев в сравнении с теми, кто не пользовался этим инструментом. По словам Harold J. Burstein, MD, PhD, FASCO, ASCO ExpertDana-FarberCancerInstitute: «Если бы какой-нибудь препарат имел преимущество в выживании такого масштаба, он был бы в розничной продаже по цене в сотни тысяч долларов. Есть очень мало лекарств, которые дают такие преимущества выживания и улучшения качества жизни! При этом, как правило, мы пренебрегаем инвестированием в электронное общение с пациентом» [21].
Однако, инструменты такого электронного дистанционного мониторинга используются пока еще достаточно редко. К настоящему времени в России не проводилось масштабных работ и рандомизированных исследований по дистанционному мониторингу онкологических пациентов. Приведенное в данной статье исследование проводилось с начала 2019 годов в Липецком областном онкологическом диспансере.
В статье приведены первые результаты этого исследования. Исследование проводилось с использованием сервиса ОНКОНЕТ, разработанного ООО «ТелеПат» [22], и внедряемого в практику российского здравоохранения Ассоциацией онкологических пациентов «Здравствуй» [23] при поддержке Фонда Президентских грантов N19-1-022113.
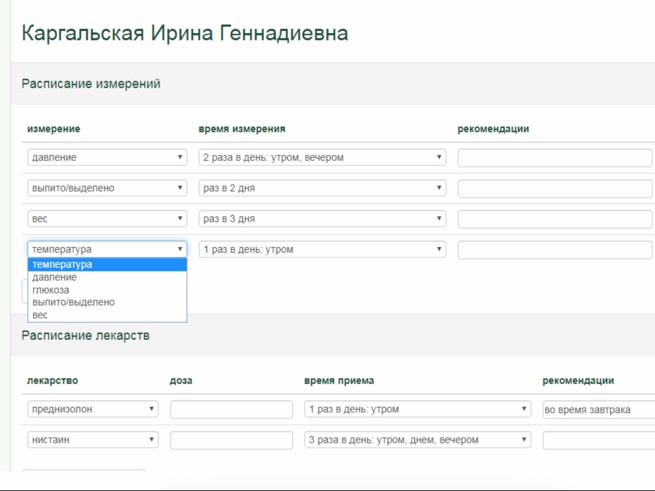
Для дистанционного мониторинга пациентов на различных этапах онкологического лечения использовалась специализированная платформа ОНКОНЕТ (разработанная ООО «ТелеПат» [22]). Платформа использовалась в следующем порядке:
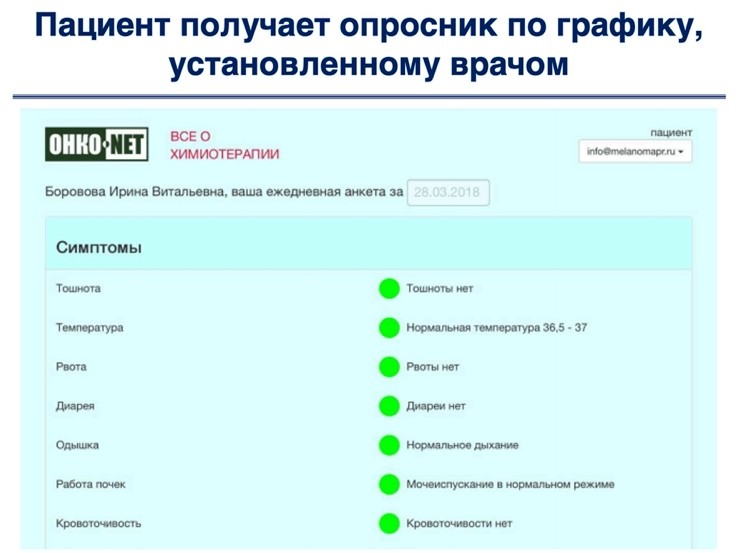
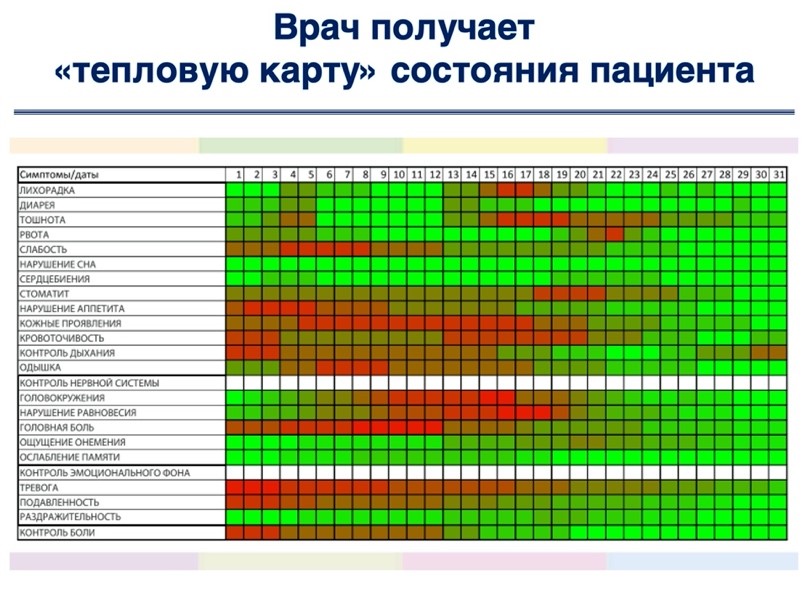
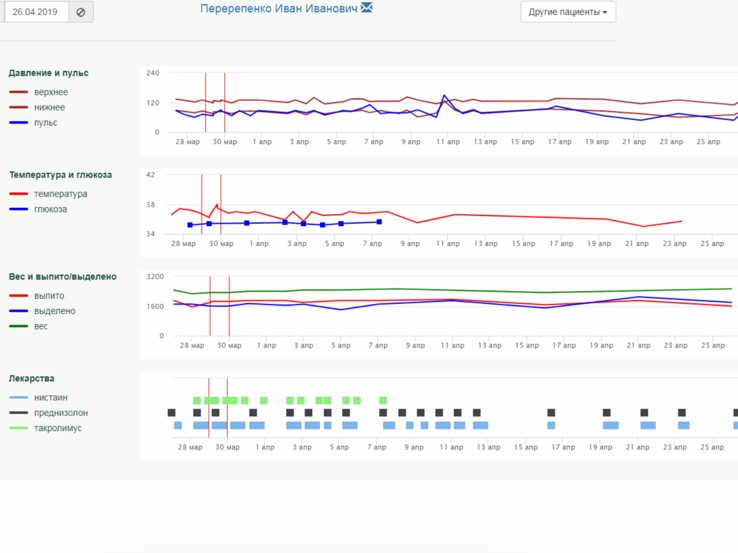
Дополнительно к опросникам врач может назначить пациенту один или несколько раз в день еще и контроль параметров (давление, температура, глюкоза, вес), а также напоминания о приеме лекарств с подтверждением приема. Измеренные пациентом показатели и отметки о приеме лекарств также включаются в «тепловую карту» в виде понятных динамических кривых.
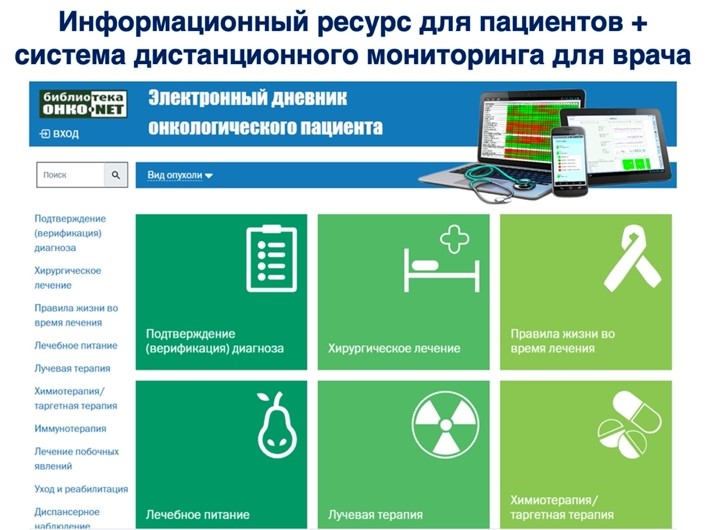
Также в ОНКОНЕТ интегрирована «Библиотека пациента», содержащая 1250 страниц пациентоориентированного информационного контента и телеподдерживающих пациентских школ от ведущих экспертов по особенностям и видам лечения, по нозологиям, правилам жизни и питания, реабилитации и уходу.
Основой описанной выше системы ОНКОНЕТ являются специализированные опросники, разработанные врачами-онкологами для дистанционной оценки состояния пациента.
Одной из главных проблем при составлении опросников было преобразование описаний оценок в понятный для пациента язык. Любые критерии, которые не может сообщить пациент, были исключены из опросников. При разработке опросников для оценки их понятности привлекались представители пациентских сообществ. Понятность опросников тестировалась на больших группах пациентов.
В системе ОНКОНЕТ разработан специальный инструментарий, позволяющий оперативно добавлять новые и модернизировать существующие опросники. Это обеспечило создание достаточно большого количества профильных опросников, позволяющих контролировать важные симптомы и побочные явления, свойственные конкретным методам лечений и состояниям онкологического пациента.
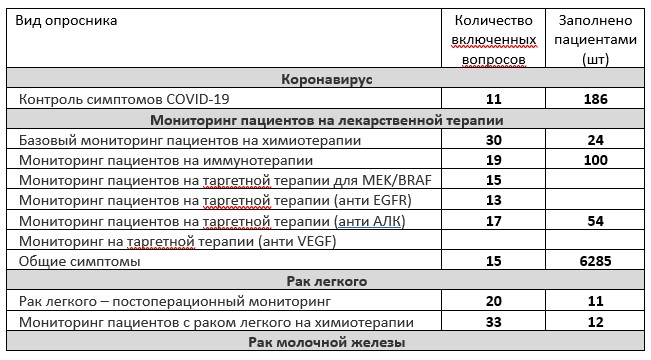
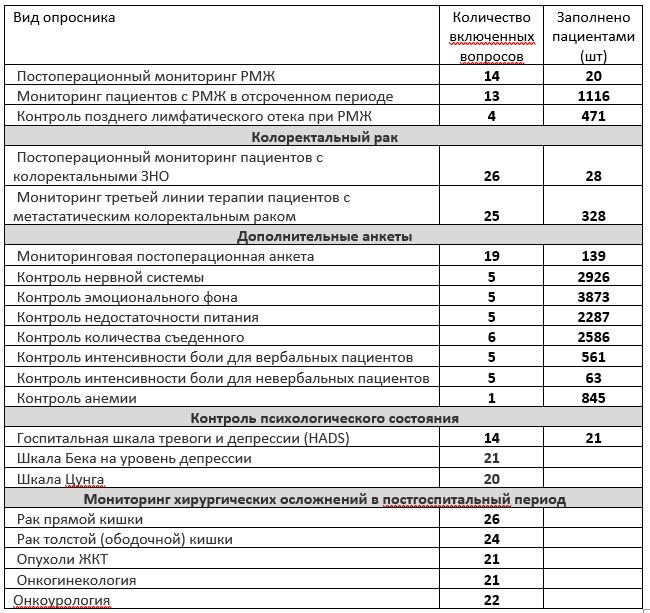
На сегодняшний день в систему включены опросники и их группы, приведенные в Таблице 1. Опросники создавались в разное время и использовались с разной интенсивностью для разных групп пациентов, поэтому количество заполненных на сегодняшний день опросников каждого вида, указанное в таблице (на момент публикации), существенно рознится.
Важно отметить, что с началом пандемии COVID-19 и публикации Минздравом информации об особой уязвимости пациентов, проходящих химиотерапию, в систему был добавлен опросник по симптомам COVID-19. Специальной рассылкой врачи были уведомлены о возможности подключить его своим пациентам. Некоторые опросники на момент публикации были подготовлены, но еще не тестировались пациентами.
Сами опросники включали в себя указанное в таблице количество вопросов и варианты ответов в одной из 2-х форм:
Пациент получал опросник, в котором все значения были предустановлены в значение «нормы» (зеленое). Но если пациент ощущал проблемы по какому-то из симптомов, то он мог открыть этот вопрос и указать значение, наиболее соответствующее его состоянию. Такой подход был избран для исключения «гипердиагностики» своего состояния пациентами. По результатам проведенных опросов пациенты указывали:
Система тестировалась в течение 2018-2020 годов в 22 медицинских организациях в 10 регионах России. В тестировании системы участвовали (на момент публикации) 174 врача и 382 пациента. При этом первоначально к системе было подключено 460 пациентов, 78 из которых – 17% – так и не начали отвечать на поступающие к ним опросники. Реально участвовавшие в мониторинге 382 пациента ответили на 92% поступивших к ним опросников, что свидетельствует о высоком уровне востребованности системы пациентами. Всего на момент публикации пациентами было заполнено 21936 опросников (в среднем – 57 на пациента) и сообщено о 193248 симптомах (более 500 в среднем на пациента).
Наибольшее число пациентов протестировано в Липецком областном онкологическом диспансере – 206 пациентов. Данные по этим пациентам более детально обработаны, сопоставлены с группой сравнения и приведены в следующем разделе.
В течение 2018-2019 годов в Липецком областном онкологическом диспансере с помощью системы ОНКОНЕТ проводился в пилотном режиме дистанционный мониторинг онкологических пациентов. В проекте принял участие 61 врач, за весь период было зарегистрировано 415 пациентов . Был организован детальный дистанционный мониторинг 206 пациентов. В исследовании участвовали пациенты с раком молочной железы, раком легкого, шейки матки и яичников, предстательной железы, щитовидной железы, почки, желудка и колоректальным раком, лимфомы Ходжкина и неходжкинкой лимфомы.
Общие отзывы о работе системы, полученные как от врачей, так и от пациентов, были весьма положительными. Однако для объективной оценки результатов решено было провести сравнение медицинских результатов с контрольной группой пациентов, находящейся на обычном наблюдении у районного онколога и не использовавшей дистанционный мониторинг состояния лечащим врачом.
Поскольку исследование изначально не планировалось как рандомизированное, для сравнения была ретроспективно подобрана группа пациентов (206 человек в группе Онконет и 209 человек в контрольной группе ), сходная по составу диагнозов и стадий заболеваний, используемым схемам лечения, а также по половозрастному составу. В этих группах оценивалась частота осложнений и побочных реакций в процессе лечения, а также важнейший показатель – перенос или отсрочка очередного курса химиотерапии.
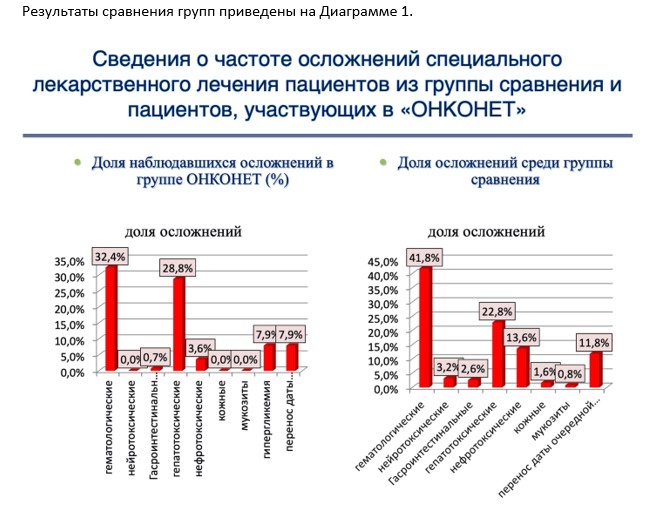
В исследуемой группе, в которой обеспечивался дистанционный врачебный мониторинг в системе ОНКОНЕТ, практически по всем параметрам выявились серьёзные преимущества. Своевременная коррекция лечения благодаря ОНКОНЕТ дала возможность уменьшить частоту осложнений, а некоторые из них свести к минимуму.
Среди наблюдавшихся осложнений в группе ОНКОНЕТ по сравнению с группой, проходящий обычное химиотерапевтическое лечение без мониторинга, реже наблюдались:
Главное, что с учетом этих результатов в полтора раза реже переносились даты очередного курсы химиотерапии (7.9% переносов в группе ОНКОНЕТ против 11.9% – в контрольной). В итоге это дало возможность выдерживать нужные интервалы между курсами лечения, что достоверно отличалось от контрольной группы, что в значительной степени улучшало выживаемость пациентов.
Перенос многих привычных повседневных действий в дистанционную форму является мощнейшим трендом в финансовой сфере, торговле, коммуникациях и медиа и практически во всех сферах жизни.
Однако, в медицине этот процесс идет значительно медленнее, в силу естественного консерватизма медицины, имеющей дело с самым дорогим – человеческой жизнью, а также в силу ряда организационных причин. Создание и внедрение системы ОНКОНЕТ проходило по настоятельным просьбам пациентов Ассоциации онкологических пациентов «Здравствуй», транслировавших нам огромную заинтересованность онкологических пациентов в том, чтобы иметь постоянный канал мониторинга и взаимодействия с лечащим врачом даже за пределами медицинской организации.
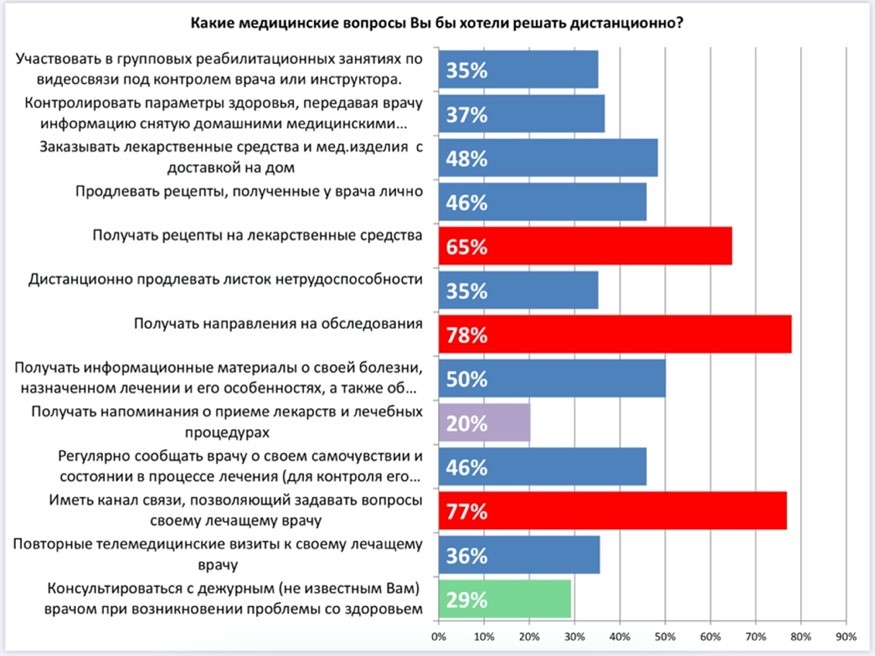
Глубокая заинтересованность хронических пациентов в такой медицинской услуге подтверждается опросом, проведенным нами в преддверии ежегодного Всероссийского конгресса пациентов. На Диаграмме 2 приведены результаты оценки востребованности различных дистанционных сервисов. 77% пациентов верят, что именно постоянный канал связи с врачом поможет снизить страх и не чувствовать себя «один на один» с последствиями токсического лечения и позволит не прерывать курс лечения из-за неконтролируемых осложнений.
Востребованность этой услуги подтверждается также и тем фактом, что 36% опрошенных заинтересованных в ней пациентов готовы приобретать ее даже как дополнительную платную услугу. Настоящее исследование является первым опытом доказательства эффективности дистанционного мониторинга в онкологии в России. Поскольку данное исследование не было спланировано заранее (в силу поэтапного инициативного внедрения системы по запросу пациентской организации). Исследование выполнено как ретроспективное.
В дальнейшем бы хотелось провести более доказательное проспективное рандомизированное исследование, в ходе которого с помощью дополнительного анкетирования оценить влияние дистанционного мониторинга на качество жизни пациентов.
Такая работа нами уже начата. Однако, на фоне поиска научных доказательств эффективности, сама жизнь внесла неопровержимые доказательства важности дистанционного мониторинга онкологических пациентов. Уже в процессе подготовки настоящей статьи разразилась пандемия COVID-19, в самом начале которой Минздравом РФ было опубликовано специальное предупреждение о необходимости максимального сокращения контактов для онкологических пациентов [24]. И предлагаемая в данной статье система ОНКОНЕТ позволит стать одним из эффективных инструментов в решении этой проблемы.
Именно использование дистанционного мониторинга на дому позволит онкологическим пациентам строго соблюдать режим самоизоляции и сократить посещения медицинских организаций, оставаясь при этом под наблюдением своего лечащего врача.
В период пандемии в систему ОНКОНЕТ был интегрирован модуль, который по обученному алгоритму автоматизирует процесс выявления случаев COVID-19 среди онкобольных, проходящих лечение и наблюдение. В систему был добавлен специальный опросник, контролирующий у пациентов дополнительные параметры: гипер/гипотермии, брадипноэ, тахипноэ, гипоксемии, дисгевзии и др. Встроенный алгоритм автоматически выявлял и генерировал экстренные уведомления лечащему врачу, обращая его внимание на возможное развитие у пациента симптомов COVID-19.
Целью этого было сокращение количества визитов заболевшего пациента в онкодиспансер и снижение риска заражения и инфекционной нагрузки для других пациентов и врачей. Очевидно, что протестированная в Липецке система дистанционного мониторинга пациентов на дому ОНКОНЕТ Система ОНКОНЕТ сможет стать помощником для пациентов на иммунотерапии – поможет вести непрерывное долгосрочное дистанционное наблюдение за пациентами даже после прекращения терапии и может также стать эффективным инструментом мониторинга пациентов на иммунотерапии ингибиторами контрольных точек, такими как антитела к PD- (L) 1 и CTLA-4 [26-35]. Ингибиторы иммунной контрольной точки действуют посредством ингибирования блокирования Т-клеток, что приводит к гибели раковых клеток, опосредованной Т-клетками.
Побочные эффекты ингибиторов иммунного контроля напоминают аутоиммунное заболевание. Наиболее распространенными являются сыпь, эндокринная токсичность, токсичность желудочно-кишечного тракта, гепатит и пневмонит. Могут возникнуть даже опасные для жизни побочные эффекты, которыми можно управлять с помощью раннего выявления, задержки или прекращения иммуноонкологической терапии и начала приема иммунодепрессантов, кортикостероидов [36-39].
Время возникновения побочных эффектов отличается от традиционной терапии рака, и они могут проявляться от нескольких месяцев до нескольких лет после начала терапии или после прекращения терапии [40-42], что делает длительное дистанционное наблюдение за пациентом чрезвычайно оправданным. Документирование состояния и самочувствия пациентов может производиться с помощью «тепловой карты» ОНКОНЕТ, формируемой автоматически на основе ежедневно заполняемых пациентом опросников.
Документирование лечения с помощью автоматической передачи «тепловой карты» в Региональную интегрированную медицинскую карту уже осуществлено нами в Санкт-Петербурге [25] при подключении городских онкологических ЛПУ Санкт-Петербургское ГБУЗ «Городской клинический онкологический диспансер», ГБУЗ «Санкт-Петербургский клинический научно-практический центр специализированных видов медицинской помощи» (онкологический).
Но самое главное – система ОНКОНЕТ позволит устранить необходимость ежедневного визита в дневной стационар частого визита или нахождения в круглосуточном стационаре только ради ежедневного получения таблетированного лекарственного препарата!
Проведенное исследование демонстрирует безусловную полезность, а также высокую медицинскую эффективность дистанционного мониторинга онкологических пациентов, особенно на фоне пандемии и необходимой самоизоляции онкологических пациентов.
Дистанционный мониторинг также повысит экономическую эффективность проводимого лечения и сократит загрузку онкологического коечного фонда. При этом дистанционный мониторинг, ведение и консультирование лечащим врачом крайне востребованы онкологическими пациентами, значительно снижают тревожность и повышают качество их жизни, удовлетворенность проводимым лечением, лояльность и приверженность проводимому лечению, ведение правильного, рекомендованного врачом образа жизни, что также способствует росту эффективности.
Чрезвычайно важно обеспечить возможность бесплатного предоставления услуг дистанционного мониторинга онкологическим пациентам. Для этого необходимо включить оплату услуг дистанционного мониторинга и консультирования онкологических пациентов в тариф ОМС.